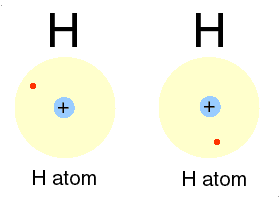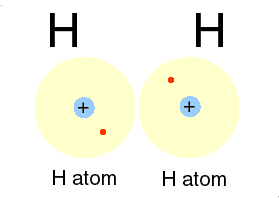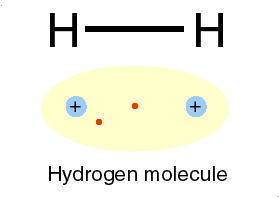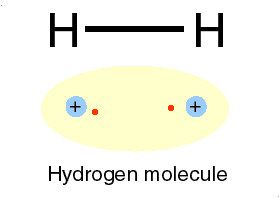
لازمه تشکیل پیوند کووالانسی بین دو اتم، این است که هر یک ازدو اتم، اربیتال تک الکترونی داشته باشند.
|
نکته ها و مفاهیم درسهایی ازشیمی پایه
|
||
|
طرح و ارایه درس ها و تمرینات وسئوالات امتحانی و کنکور و ازمایشهای شیمی ومطالب مختلف دیگر |
داروها خانواده ای از مواد شیمیایی هستند؛ بنابراین، مصرف آن ها به مقدار مناسب نكته حساس و مهمی است. برخی از داروها كه عوارض جانبی چندانی ندارند به طور آزاد و بدون نیاز به نسخه پزشك در دسترس همه افراد قرار میگیرند؛ در حالیكه اگر به مقدار مصرف مجاز آن ها توجه نشود، میتوانند آسیب های جدی در پی داشته باشند. پاراستامول كه با نام تجاری استامینوفن عرضه میشود یكی از این داروهاست.
پاراستامول از داروهایی است كه معمولاً در بیشتر نسخه ها برای درمان سرماخوردگی و آنفلوآنزا تجویز می شود. مصرف این دارو بنا به دوز توصیه شده توسط پزشك، خطری ندارد اما مصرف بیش از اندازه آن می تواند به مسمومیت كبدی بینجامد. چنانكه در كشورهای غربی مهمترین علت نارسایی كبد مسمومیت ناشی از پاراستامول بوده است.
در این میان، مشاهده شده است كه مصرف مشروبات الكلی، بر مسمومیت با پاراستامول می افزاید .
سرگذشت استامینوفن
در گذشته های دور از تركیب های موجود در پوست درخت بید و درخت اوكالیپتوس برای پایین آوردن دمای بدن استفاده میشد. ترکیب های موجود در درخت اوكالیپتوس را در ساخت گنه گنه كه برای درمان مالاریا بكار میرفت نیز بكار می بردند.
تا اواخر قرن نوزدهم تلاش برای پالایش و جداسازی تركیب های مؤثر از پوست این درختان از جمله سالیسیلیک اسید ادامه داشت تا اینكه فلیکس هافمن در شركت آلمانی بایر موفق به انجام آن شد. هنگامی كه در دهه 1880 درختان اوكالیپتوس كمیاب شدند، جست و جو برای یافتن یك جایگزین مناسب در این زمینه آغاز شد. در سال 1886 ، پروفسور آدولف كاسمالدر از دانشگاه استراسبورگ كه در حال مطالعه روی تأثیرات ماده ضدانگل نفتالین بود، به اشتباه مقداری استانیلید را در بررسی های خود بكار گرفت. به این ترتیب بود كه آثار كاهش دهنده گرما توسط استانیلید آشكار شد. اما كشف خواص ضد درد آن، سال ها پس از این ماجرا صورت گرفت و به هرحال، استانیلید با نام تجاری آنتی فیبرین به بازار راه یافت.
در پایان سال 1880پارانیترو فنول با قیمتی ارزانتر از استانیلید وارد بازار شد. ادامه پژوهش ها روی این ماده و تلاش برای یافتن كاربرد مناسب برای آن توجه دیگران را به استو فنی تیدین جلب كرد كه از آنتی فیبرین قویتر بود و اثرهای جانبی كمتری داشت: این ماده با نام تجاری فناستین كاربرد پیدا كرد.
پاراستامول در سال 1878 برای نخستین بار از واكنش اكسایش پارانیتروفنول با قلع به دست آمد اما تا سال 1893 كاربرد درمانی پیدا نكرد. در این سال بود كه پاراستامول در ادرار افرادی كه فناستین مصرف كرده بودند، شناسایی و در پی آن اعلام شد كه پاراستامول از سوخت و ساز استانیلید نتیجه شده است اما این كشف چندان مورد توجه قرار نگرفت. سرانجام در بررسی بیماری میتوگلوبین - حالتی كه خون، توانایی حمل اكسیژن را از دست میدهد و به مرگ می انجامد - علت بروز این بیماری به مصرف استانیلید ارتباط داده شد و پژوهشگران تأکید كردند اثرهای استانیلید به عنوان مسكن، به دلیل ماده ای است كه از سوخت و ساز فعال این ماده تولید میشود.
این ماده، همان پاراستامول بود كه مشخص شد اثرهای منفی استانیلید را ندارد و می تواند به عنوان جایگزین آن مورد استفاده قرار گیرد.
مقدار مصرف
امروزه استامینوفن با نام شیمیایی 4 -هیدروكسی فنیل استامید، به عنوان داروی تب بر و تسكین دهنده كاربرد گسترده دارد. شكل زیر ساختار شیمیایی این ماده را نشان می دهد.
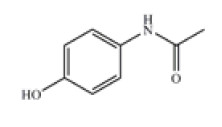
مصرف روزانه این دارو در بزر گسالان 4gو در كودكان 90mg به ازای هر كیلو وزن بدن تعیین شده است. در مجموع، یك قرص 500میلی گرمی از این دارو، هر 4 تا 6 ساعت برای افراد بالاتر از 12 سال كافی است و مقدار مصرف آن نباید از 4g در روز فراتر باشد. گفتنی است مصرف 150mg از آن به ازای هر کیلو وزن بدن در بزر گسالان میتواند به مسمومیت بینجامد.
جذب، سوخت و ساز، دفع
استامینوفن به سرعت و به طور كامل از دستگاه گوارش جذب شده، در خلال 1 تا 5ساعت مقدار آن در پلاسما مشخص میشود. 90تا 95 درصد سوخت و ساز این دارو در كبد انجام میگیرد و از راه ادرار دفع میشود. نیم عمر دفعی آن در دوزهای معمول حدود 2 ساعت است و در دوزهای بالاتر به بیش از 12 ساعت میرسد.
90 تا 93 درصد استامینوفن در كبد به گلوكوزونیک و سولفات مزدوج تبدیل می شود. دفع این مواد از راه ادرار انجام می گیرد. حدود 2 درصد از آن بدون تغییر از راه كلیه دفع می شود و 5 درصد از راه سیتوكروم ،P450 توسط آنزیم ها مورد سوخت و ساز قرار میگیرد.
این مسیر یک واكنش میانی را شامل میشود كه با تولید N- استیل پارابنزو كینون ایمین، ،NAPBQI همراه است. این فراورده می تواند به سرعت به گلوتاتیون بچسبد و از ایجاد مسمومیت جلوگیری كند. اگر مقدار گلوتاتیون از 30درصد مقدار معمول آن كمتر شود، NAPBQIبه غشای سلول های كبدی می چسبد و باعث مرگ آن ها می شود.
مسمومیت با استامینوفن
دو نوع مسمومیت در این زمینه وجود دارد كه عبارت اند از:
اگر بیمار، بیش از 150mg استامینوفن را به ازای هر کیلو وزن بدنش به طور یكباره مصرف كند، امكان ابتلای او به مسمومیت شدید وجود دارد. پس اگر به مصرف بیش از اندازه این دارو شك كردید، باید درمان مسمومیت را هرچه زودتر آغاز كنید؛ حتی اگر نشانه های مسمومیت ظاهر نشده باشد. گفتنی است اگر 24 ساعت پس از مصرف بیش از حد استامینوفن، درمان شروع نشود، جلوگیری از آسیب كبدی یا مرگ میتواند امكان ناپذیر باشد. بنابراین، روزانه نباید بیش از 5 نوبت استامینوفن به كودكان زیر 12 سال داده شود.
عوارض جانبی
چنانچه هر یك از نشانه هایی كه در پی آمده است مشاهده شد، مصرف دارو را قطع و به پزشك مراجعه كنید:
زردی پوست یا چشم، اسهال، بی اشتهایی، استفراغ، معده درد، تورم یا حساسیت در بالای شكم، مدفوع سیاه رنگ و قیر مانند، ادرار كِدِر و خونی، كاهش ناگهانی ادرار، كبودی یا خونریزی غیرعادی، دانه یا جوش های ریز جلدی، زخم دهان، تب یا گلودردی كه پیش از درمان وجود نداشته است.
هشدار
در این موارد باید با احتیاط فراوان، استامینوفن را مصرف كنید:
رسم آسان ساختارهای شیمیایی در Word با نرم افزار Fx ChemStruct v1.203.2 |
9 اسفند 1387 |
|
مدتی پیش نرم افزار FxChem محصول شرکت efofex را در سایت معرفی کردیم که با آن می توانستید به راحتی در Word معادلات شیمیایی را درج کنید. نرم افزاری که در این جا معرفی می کنیم نیز محصول همان شرکت است، اما یک قدم پا را فراتر گذاشته به سراغ رسم ساختارهای هندسی مولکول ها رفته است و کار شما را در رسم ساختارهای شیمیایی در Word بسیار ساده کرده است. به عنوان مثال:
برای راهنمایی بیشتر به Help نرم افزار مراجعه کنید. (از منوی Help گزینه Read help file را انتخاب کنید.)
:: روش نصب :: با اجرای فایل fxt100.exe نرم افزار را با توجه به نکات زیر نصب کنید: 1- در مراحل نصب وقتی به قسمت Registration Name و Unlock Code رسیدید، فایل Keygen.exe که در پوشه Keygen قرار دارد اجرا کنید. در قسمت Name نام دلخواه خود را بنویسید و روی دکمه Generate کلیک کنید . آن گاه کد ظاهر شده در قسمت Registration Code را کپی کرده، به پنجره نصب نرم افزار بازگردید و آن را در قسمت Unlock Code درج کنید. در قسمت Registration Name نیز همان نامی را که در پنجره Keygen وارد کرده بودید درج کنید و سپس روی Next کلیک کنید.
2- در مرحله بعد I accept... را انتخاب کنید و روی Next کلیک کنید. 3- در یکی از مراحل نصب باید نسخه ای از Word را که روی سیستم شما نصب است، انتخاب کنید تا این نرم افزار روی Word فعال شود.
:: روش استفاده در Word :: در Word 2003 پس از نصب نرم افزار یک نوار ابزار جدید به Word اضافه می شود که شامل دو آیکون می باشد. در Word 2007 نیز این آیکون ها به ریبون Add-Ins اضافه می شود. با کلیک یکی از این دو آیکون که در شکل زیر نشان داده شده است، پنجره نرم افزار Fx ChemStruct باز می شود.
مانند شکل زیر فرمول را در کادر بالا تایپ کنید تا خود نرم افزار ساختار آن را رسم نماید.
برای خارج شدن از محیط برنامه و درج ساختار رسم شده
در Word، روی دکمه
با استفاده از نوار ابزار پنجره ChemStruct می توانید در نحوه نمایش ساختارهای رسم شده تغییراتی انجام دهید، مانند: نمایش H ها به صورت باز، نمایش جفت الکترون های ناپیوندی، نمایش جفت الکترون به جای پیوند کوالانسی و ...
Size: 1.33 MB
در صورت درخواست شما، می توانیم این نرم افزار را همراه سایر نرم افزارهای معرفی شده در سایت را برای شما ارسال کنیم: کلیک کنید.
|
دوستان عزیز بر روی کلمه نردبان شیمی کلیک کنید.سپس نام و نام خانوادگی خود را در قسمت مشخص شده بنویسید .تا قسمتی از نام شما به صورت نماد شیمیایی نوشته شود .مثل تصویر زیر
با استفاده از کلید اینتر شکلهای متفاوتی می بینید.
کتاب جیبی گیاهان دارویی

تعداد صفحات: ۳۶ ||| حجم فایل: ۴۸۸ KB ||| زبان : فارسی
همزمان با پيدايش انسان ها، استفاده از گياهان دارويي نيز آغاز شد. با مطالعه در تمدن اقوام قديمي به مصرف گياهان دارويي به عنوان دارو، سم، مواد پاك كننده و رنگ بر مي خوريم. مقايسه مواد شيميايي ساخته دست بشر با مواد شيميايي موجود در گياهان، مانند قطره اي در مقابل اقيانوس است. پس بیاید گیاهان دارویی را بهتر بشناسیم.
پسورد فایل فشرده : shiminovin

این اسید که جوهر حسن لبه هم نامیده می شود ، تاریخچه اکتشاف جالبی دارد . شبی زکریای رازی دانشمند بزرگ ایرانی تا دیر وقت در آزمایشگاهش کار میکرد . او روزها و شبهای زیادی را صرف آزمایشهای خود کرده بود ، بنابراین در کنار ماده جدیدی که کشف کرده بود و خود نیز از کشف آن بی خبر بود خوابش برد . ماده ای که رازی کشف کرده بود اسید بنزوئیک بود .
در آزمایشگاه او مردی به نام حسن کار می کرد پس از مدتی که از خواب رازی گذشت حسن وارد آزمایشگاه شد او در بدو ورود متوجه بوی بسیار خوبی شد و ماده جدیدی که توسط رازی کشف شده بود توجه او را به خود جلب کرد او بزودی فهمید که این بوی خوب مربوط به آن ماده است . بوی این اسید شبیه تمشک بوده و بسیار جذاب و مطبوع است . حسن که فکر می کرد ماده کشف شده خوراکی است کمی از آنرا روی لبش چکاند که ناگهان لبش به شدت قرمز شده و شروع به سوزش کرد . ناله حسن زکریا را از خواب بیدار کرد وقتی علت ناراحتی او را جویا شد به کشف جدید خود پی برده و به مناسبت این اتفاق بامزه نام ماده جدید را جوهر حسن لبه گذاشت .
بنزوئیک اسید یک اسید آلی است که در تمشک و پوست برخی از درختان
وجود دارد و از آن و برخی نمکهایش بعنوان ماده محافظ یا نگهدارنده استفاده می شود
مثلاً در انواع آب میوه و نوشابه.
جوهر
حسن لبه : حسن لبه یکی صمغ خالص که به شکل قطعاتی است سفید رنگ، جامد، اشکی
شکل، شکننده دارای جوهر حسن لبه گفته می شود، اسیدی است متبلور، سفید رنگ به فرمول
خام . ترکیبات شیمیایی. از نظر ترکیبات شیمیایی عمده ترین مادة موجود در حسن لبه
بنزوئیک اسید میباشد
اسید
بنزوئیک برای محافظت مواد
غذایی بکار میرود. از
این ماده در ترکیب با اسید سالسیلیک یک نوع داروی ضد قارچ
پوستی میسازند. این
ماده همچنین در خمیر دندان به عنوان
ضدعفونی کننده استفاده میشود.
آلکیل هالیدها همانطور که از نامشان پیدا است آلکیلهایی هستند که با هالوژن پیوند تشکیل دادهاند. این ترکیبات دارای فرمول عمومی R-X هستند که R یک گروه آلکیل و یا گروه آلکیل استخلاف شده و X اتم هالوژن است. آلکیل هالیدها معمولا از الکل تهیه میشوند و نقطه آغاز سنتز برای بسیاری از مواد هستند. مشخصترین واکنشهای آنها واکنشهایی هستند که روی گروه عاملی آنها ( اتم هالوژن ) انجام میشوند. آلکیل هالیدها در آب نامحلولاند اما در حلالهای آلی مانند بنزن ، اتر ، کلروفرم و... محلول هستند.
آلکیل هالیدها در مقایسه با آلکیل اولیهای که از آن بوجود آمدهاند بخاطر وزن مولکولی بیشتر دمای جوش بالاتری دارند. بعنوان مثال هالو آلکنها در مقایسه با آلکانهایی با تعداد کربن برابر دمای جوش بالایی دارند. در یک گروه آلکیل معین با افزایش وزن اتمی هالوژن دمای جوش افزایش مییابد. فلوئورورها زود جوشترین و یدیدها دیر جوشترین هالیدها هستند.
شاخهدار
شدن در گروههای آلکیل یا در کربن دارای پیوند هالوژن سبب پایین آمدن دمای
جوش نسبت به آلکیل هالیدهای راست زنجیر با همان تعداد کربن میشود. با
وجود قطبیت متوسطی که دارند در آب نامحلولند که علت احتمالی آن میتواند
ناتوانی در تشکیل پیوندهای هیدروژنی
باشد. این ترکیبات حلالهای خوبی برای سایر ترکیبات با قطبیت کم از جمله
خودشان هستند و چون نمیتوانند یونهای ساده را بطور قابل ملاحظهای حلال
پوشی کنند نمکهای معدنی در آنها نامحلول هستند. آلکیل هالیدهای دارای یدید برمید و پلی کلرها چگالتر از آب هستند.
آلکیل هالیدها را با توجه به اینکه کربن حامل هالوژن ، به چند گروه آلکیل متصل است طبقهبندی میکنند.
آلکیلهای نوع 1 : کربن حامل هالوژن را با یک گروه آلکیل پیوند دارد.
الکیلهای نوع 2 : کربن حامل هالوژن با دو گروه آلکیل پیوند دارد.
آلکیلهای نوع 3 : کربن حامل هالوژن با سه گروه آلکیل پیوند تشکیل داده است.
البته لآلکیل هالیدها را از هالوژندار کردن مستقیم آلکانها تهیه نمیکنند زیرا مخلوطی از ایزومرها تشکیل میشود.
آلکیل هالیدها در حضور اتر خشک با فلز منیزیم واکنش نشان داده و واکنش گرینیارد ( RMgX ) را ایجاد میکنند. این ترکیبات میتوانند در حضور فلز و اسید به آلکیل اولیه احیا شوند.
مهمترین روش شناسایی آلکیل هالیدها این است که به مدت چند دقیقه با محلول الکلی نیترات نقره حرارت داده شوند. با تشکیل رسوبی که در اسید نیتریک رقیق نامحلول است هالوژن شناسایی میشود. ترتیب واکنشپذیری هالیدهای معین با نیترات نقره بصورت RI> RBr> RCL است و در مورد یک هالوژن معین واکنش آلکیل هالیدها بصورت > 2> 1 آلکیل هالید 3 درجه است.
|
اولا
گازهایی که استفاده میشوند باید به سیم تنگستن موجود در لامپ صدمه نزنند.
به همین دلیل از اکسیژن استفاده نمیکنند چون تنگستن را اکسید میکند.
ثانیا اگر از گازی اصلا استفاده نکنند یعنی خلا باشد تنگستن بخار میشود
از گازهایی باید استفاده کرد که حالت نجیب داشته باشند (یعنی به سختی
واکنش بدهند) مثل آرگون ، نئون و هلیوم بهتر است بدانید نور لامپ در مقابل
گازهای زیر چه رنگی میشود: Naبخار======================== زرد طلایی Hg بخار======================= سبز پستهای H , He , Ar ................................................ سفید Ne=========================== نارنجی هوا در شرایط خاص================= بنفش |
کربن در تمامی جانداران وجود داشته و پایه شیمی آلی را تشکیل می دهد.همچنین این غیر فلز ویژگی جالبی دارد که می تواند با خودش و انواع زیادی از عناصر دیگر پیوند برقرار کند( تشکیل دهنده بیش از ده میلیون ترکیب ).در صورت ترکیب با اکسیژن تولید دی اکسید کربن می کند که برای رشد گیاهان ، حیاتی می باشد.در صورت ترکیب با هیدروژن ترکیبات مختلفی بنام هیدرو کربنها را بوجود می آورد که به شکل سوختهای فسیلی، در صنعت بسیار بنیادی هستند. وقتی هم با اکسیژن و هم با هیدروژن ترکیب گردد ،گروه زیادی از ترکیبات را از جمله اسیدهای چرب را می سازند که برای حیات و استر ، که طعم دهنده بسیاری از میوه ها است ، ضروری است.ایزوتوپ C-14 به طور متداول در سن یابی رادیواکتیو کاربرد دارد.
یون فلوئور چگونه باعث سختی دندان ها می شود؟
اجزای معدنی یا قسمت سخت دندان ها و استخوان ها شامل دو ترکیب کلسیم دار است . کلسیم کربنات در شکل متبلور آن در دندان ها و استخوان ها حضور دارد که کانی شناسان به آن آراگونیت می گویند. و دومین ترکیب کلسیم دار که در دندان ها یافت می شود ، کلسیم هیدروکسی فسفات [Ca5(OH)(PO4)3] یا هیدروکسی اپاتیت است. این دو ترکیب به اسید حاصل از تجزیه ی غذا ها در دهان حساس هستند .و به دلیل بازی بودن خاسیت هیدروکسی اپاتیت ، این ماده به اسید ها حساس تر است. اگر در دوران تشکیل دندان غلظت یون فلوئورید کافی باشد به جای هیدروکسی اپاتیت ، فلوئورو اپاتیت [Ca2F(PO4)] به وجود می آید . هر دو اپتایت دارای یک ساختمان کلی هستند به طوری که از لحاظ کلی ساختمان دندان تغییر نمی کند . چون فلوئورو اپاتیت خاصیت بازی هیدروکسی اپاتیت را ندارد و به آسانی مورد حمله ی اسید ها قرار نمی گیرد، احتمال پوسیدگی دندان ها کمتر می شود.
چسبهای
بسیاری برای متصل کردن اجسام مشابه یا غیر مشابه در دسترس هستند. امروزه
تقریبا استفاده از چسبانندههای طبیعی مثل سریش بجز موارد استفاده خاصی
منسوخ شده است. در عوض هر روز شاهد تولید و سنتز چسبهای جدیدی هستیم که
منشأ پلیمری دارند. چسبها در اشل صنعتی به شیوههای گوناگونی تهیه
میشوند که در این بحث برخی از مهمترین روشها را معرفی میکنیم.
پخت یا پروراندن رزین چسب به صورت یک جسم جامد
اپوکسیها
معروفترین چسبهای این گروه هستند که با استفاده از رزینهای سیکلوآلیفاتیک
، طوری فرمولبندی میشوند که در دماهای بالا قابل استفاده باشند. برای
سنتز چسبهای قوی و نیمه انعطافپذیر از رزینهای اپوکسی با عوامل پخت پلی
آمین یا پلی آمید استفاده میشود و بیشتر اپوکسیها بدون استفاده از مواد
افزودنی هم چسبندگی خوبی دارند. زمان پخت میتواند از ثانیهها تا روزها
طول بکشد که این امر به کاتالیزورها و دما بستگی دارد.
اپوکسی فنولی با استفاده از این چسبها میتوان اتصالاتی پدید آورد که تا 315ºC پایدار
هستند. این چسبها در دماهای بالا پرورده میشوند و از آنها برای پیوند
ساختمانی و لانه زنبوری استفاده میشود. از دیگر چسبهای این گروه میتوان
از پلی استرها (که ارزان قیمت و زودگیر و شکننده هستند)، سیلیکونها ،
سیانوآکریلاتها و آکریلیها ، نام برد.
به ادامه مطلب مراجعه کنید . . .
تبخیر حلال از محلول پلیمر گرمانرم
مواد
پلیمری حل شده در حلالها میتوانند چسبهای مفیدی تشکیل دهند. با تبخیر
حلال ، پلیمر گرمانرم جامدی حاصل میشود که به چسب حلال معروف است. از این
گروه میتوان نیتروسلولز را نام برد که سالها محلول 10 تا 25 در صد آن به
عنوان چسب هواپیما و یا برای مصارف خانگی استفاده میشد.
آکریلیها ، محلول رزینهای آکریلیک پرورده شده هستند و به چسبهای پلاستیک مشهورند و برای متصل کردن پلاستیکهای ABS ، پلی استیرن و آکریلی مؤثرند. سیمانهای لاستیکی هم جزو چسبهای حلال میباشند.
تبخیر آب از یک شیرابه پلیمری
شیرابهها
از ذرات کوچک پلیمر پرورانده شده معلق در آب تشکیل شدهاند و در موقع
تبخیر آب ، ذرات بوسیله نیروهای واندرواسی به یکدیگر متصل میشوند. رزین
خشک شده ، دیگر در آب حل نمیشود. از این چسبها میتوان پلی وینیل استات
را نام برد که برای اتصال قطعات چوبی بکار میرود و به صورت شیرابه (محلول
در آب) عرضه میشود و به نام چسب سفید یا چسب چوب معروف است.
سرد کردن پلیمر گرمانرم ذوب شده
پلیمرهایی
که در دمای مناسب ذوب میشوند و دارای نیروهای جاذبه زیادی میباشند،
بعنوان چسب داغ ذوب شناخته میشوند. از انواع پلی استرهای گرمانرم ، پلی
آمیدها و پلی اتیلنها ، بعنوان چسب داغ ذوب استفاده میشود. این چسبها به
صورت لولههایی با ضخامت کم در بازار موجود میباشد. در اثر حرارت دادن ،
لوله ذوب و جاری میشود و با مالیدن به سطح جسم و فشردن سطوح به همدیگر ،
اتصال در ضمن سرد شدن انجام میشود.
عوامل اتصال دهنده
موادی
که با شیمی دوگانه وجود دارند، میتوانند به چسبندگی کمک کنند. این
ترکیبات دارای دو گروه عاملی متفاوت در دو انتها میباشند و معمولیترین
آنها عوامل اتصال دهنده سیلان میباشند. یک انتهای این ترکیبات ، تولید
چسبندگی با شیشه یا مواد معدنی دیگر میکند و انتهای دیگر از نظر شیمیایی
فعال میباشد.
اخیرا ترکیباتی به نام تیتاناتها وارد بازار شدهاند که مانند سیلان دارای شیمی دوگانه هستند و شبیه آنها عمل میکنند، اما برتریهایی هم در برخی خواص نسبت به سیلانها دارند.
زنجبیل (زنجفیل) به عنوان گیاهی دارویی از زمان های دور كاربرد داشته است. ارزش دارویی این گیاه به مقدار تركیب های سوزاننده و اسانس های موجود در آن بستگی دارد. از جمله اثرهای درمانی زنجبیل میتوان به خواص ضدقندخون، كاهنده كلسترول، تحریك دستگاه ایمنی و پاد اكسندگی آن اشاره كرد. در این مقاله، تركیب های شیمیایی كه مسئول خواص درمانی زنجبیل هستند و اثرهای درمانی آن مورد بررسی قرار می گیرد.

Normal 0 false false false EN-US X-NONE AR-SA MicrosoftInternetExplorer4
/* Style Definitions */ table.MsoNormalTable {mso-style-name:"Table Normal"; mso-tstyle-rowband-size:0; mso-tstyle-colband-size:0; mso-style-noshow:yes; mso-style-priority:99; mso-style-qformat:yes; mso-style-parent:""; mso-padding-alt:0in 5.4pt 0in 5.4pt; mso-para-margin-top:0in; mso-para-margin-right:0in; mso-para-margin-bottom:10.0pt; mso-para-margin-left:0in; line-height:115%; mso-pagination:widow-orphan; font-size:11.0pt; font-family:"Calibri","sans-serif"; mso-ascii-font-family:Calibri; mso-ascii-theme-font:minor-latin; mso-fareast-font-family:"Times New Roman"; mso-fareast-theme-font:minor-fareast; mso-hansi-font-family:Calibri; mso-hansi-theme-font:minor-latin;}
كاربرد گیاه زنجبیل در طب سنتی به گذشته های بسیار دور باز می گردد؛ چنانكه در عطاری های قرون وسطی جایگاه خاصی داشته و در درمان نفخ و تهوع مورد استفاده بوده است. كارشناسان طب هندی از آن به عنوان دارویی جهانی یاد كرده اند. كاربرد گسترده این گیاه نه تنها به خواص ضدقارچ و ضدباكتری آن وابسته است بلكه از اثر تسكین بخشی كه بر دستگاه گوارش دارد، ناشی می شود.
زنجبیل كه در ایران باستان به ژنگویر معروف بوده است، از راه كشورهای عربی به غرب راه یافته است. امروزه در تهیه داروها و مكمل های غذایی از زنجبیل استفاده می شود.
تركیب های شیمیایی
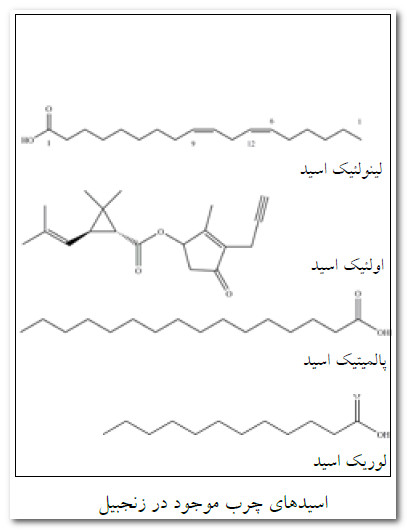
بخش اصلی مورد استفاده زنجبیل، ساقه زیرزمینی آن است كه ریزوم نامیده می شود. ساقه های هوایی گیاه كه به طور عمودی از ریزوم خارج می شوند، حامل برگ های پهن و گل های زرد رنگ گیاه اند. حدود 50 تا 70 درصد زنجبیل را انواع قندها تشیكل می دهد و مقدار اسیدهای چرب كه به شكل آزاد یا تركیب در آن وجود دارند به 3 تا 18 درصد میرسد.
شكل زیر، ساختار و فرمول شیمیایی اسیدهای چرب موجود در زنجبیل را نشان می دهد.
در بخش های زیرزمینی زنجبیل، 1 تا 3 درصد اسانس روغنی فرّار وجود دارد كه تركیب هایی مانند كامفن، فلاندرن، زیجی برن، سینئول، سیترال و بورنئول را دربرمی گیرد. بوی تند و اثرهای اصلی زنجبیل ناشی از وجود اولئورزین هایی همچون جینجرول ، شوگائول و زینگرون است كه حدود 4 تا 7.5 درصد گیاه را تشیكل می دهند.
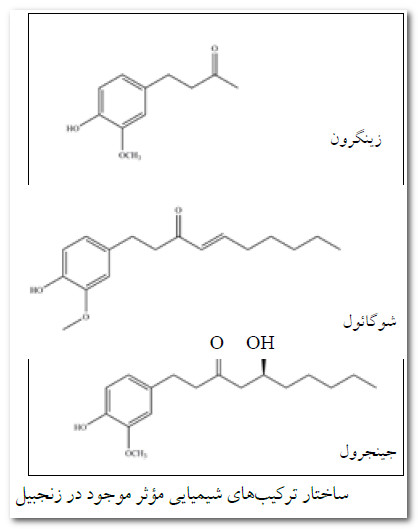
خاصیت پاداكسندگی این گیاه نیز از شوگائول و جینجرول نتیجه میشود. مزه تند و سوزش آور زنجبیل ناشی از وجود همین تركیبهاست.
آمینواسیدها، پروتئین، مواد معدنی و ویتامین هایی همچون ویتامین A، از دیگر مواد موجود در گیاه زنجبیل اند.
اثرهای درمانی
سرطان روده در مردان نسبت به زنان، بیماری بسیار شایع تری است. این بیماری در ایالات متحده دومین عامل كشنده به شمار میرود. بنابر پژوهش هایی كه در دانشگاه مینه سوتا انجام گرفته است، مصرف جینجرول كه از زنجبیل به دست می آید در درمان سرطان روده سودمند است.
از پژوهش های دانشگاه ایالت جورجیا چنین برمی آید كه عصاره زنجبیل از رشد سلول های سرطانی در پروستات جلوگیری میكند. مصرف زنجبیل تا حدود 60 درصد فروكش کردن توده سرطانی را در پی داشته است؛ بدون آنكه اثرهای جانبی یا مسمومیت از خود به جا بگذارد. مصرف روزانه 3.5 g عصاره زنجبیل، اثرهای ضدسرطانی قوی را به روشنی نشان داده است.
بنا به بررسی های انجام شده در مركز سرطان دانشگاه میشیگان، گَرد زنجبیل بر سلول های سرطانی در بخش های مختلف بدن غلبه میكند و به ویژه، از مقاومت سلول های سرطانی تخمدان در برابر داروهای ضدسرطان میكاهد.
به تازگی مشخص شده است كه زنجبیل می تواند در كاهش فشارخون سودمند باشد. در حالیكه فشارخون بالا می تواند به بیماری های قلبی، نارسایی كلیه و سكته بینجامد، مواد موجود در زنجبیل با جلوگیری از تشكیل رسوب كلسیم در درمان و پیشگیری از بیماری های كلیه مؤثر واقع می شود، با تحریک گردش خون احتمال سكته های قلبی و مغزی را كاهش می دهد و از فشارخون میكاهد. توصیه میشود كسانی كه به دلیل ابتلا به بیماری فشارخون از دارو استفاده میكنند و تمایل دارند به جای دارو، از زنجبیل استفاده كنند، با پزشك خود مشورت كنند؛ زیرا مصرف مكمل زنجبیل، 14 روز پیش از زمان جراحی باید متوقف شود.
زنجبیل منبعی از ویتامین ها از جمله ویتامین B6 ، و مواد معدنی مانند پتاسیم و منیزیم است كه در برابر بیماری های قلبی از انسان حمایت میكند. به نظر می رسد وجود این مواد است كه با جلوگیری از گرفتگی رگ ها كاهش فشارخون را در پی دارد و از لخته شدن خون جلوگیری میكند.
زنجبیل منبعی سرشار از منگنز است؛ ماده ای معدنی كه در رفع مشكلات باروری در مردان، ناشی از كم بودن سلول های جنسی یا پایین بودن هورمون تستوسترون نقشی اساسی دارد.
منیزیم و منگنز موجود در زنجبیل به تنظیم قندخون در افراد مبتلا به بیماری دیابت نوع 2، كمك میكنند.
بنابر پژوهش ها، خواص ضدباكتری و اثرهای ضدالتهاب زنجبیل می تواند در كاهش انواع دردها سودمند باشد. زنجبیل از روغن های فرّار، پروتئاز و چربی هایی برخوردار است كه موجب كاهش میگرن یا پیشگیری از آن می شوند. شاید این خاصیت، ناشی از اثر زنجبیل در كاهش حالت تهوع باشد كه معمولاً با دردهای میگرنی همراه است. به هرحال، استفاده از زنجبیل درمان قطعی و كاملی برای میگرن نیست.
منبع :رشد
منبع:رشد
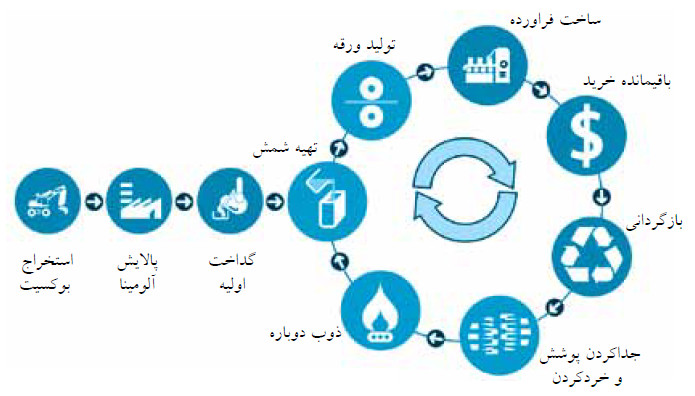
بازیافت، یکی از روش های سودمند در جمع آوری مواد است. صنعت بازیافت افزون بر صرفه جویی در منابع اقتصادی و صنعتی، كمك شایانی به حفظ محیط زیست میكند. برای بازیافت و بهینه انجام شدن آن به تلاش صاحبان صنایع، سازمان های مرتبط و كمك مردم نیاز است.
به دلیل كاربرد گسترده آلومینیم در صنعت مانند صنایع غذایی، سازه های مقاوم، هوانوردی و ترابری، بازیافت آن مهم و ضروری است. در برخی كشورها با جمع آوری آلومینیم های قراضه و حمل آن به كارخانه های بازیافت، دوباره آن را طی مراحل ذوب تا پالایش به دست می آورند.
Normal
0
false
false
false
EN-US
X-NONE
AR-SA
/* Style Definitions */ table.MsoNormalTable {mso-style-name:"Table Normal"; mso-tstyle-rowband-size:0; mso-tstyle-colband-size:0; mso-style-noshow:yes; mso-style-priority:99; mso-style-qformat:yes; mso-style-parent:""; mso-padding-alt:0in 5.4pt 0in 5.4pt; mso-para-margin-top:0in; mso-para-margin-right:0in; mso-para-margin-bottom:10.0pt; mso-para-margin-left:0in; line-height:115%; mso-pagination:widow-orphan; font-size:11.0pt; font-family:"Calibri","sans-serif"; mso-ascii-font-family:Calibri; mso-ascii-theme-font:minor-latin; mso-fareast-font-family:"Times New Roman"; mso-fareast-theme-font:minor-fareast; mso-hansi-font-family:Calibri; mso-hansi-theme-font:minor-latin;}
در دنیای غرب، بازگردانی مواد، عملی سخت و طاقت فرسا و كاری است كه انجام آن همچون ورزش و داشتن رژیم غذایی، ضروری است. در هند وضعیتی كاملاً متفاوت حاكم است. در این كشور امرار معاش هزاران تن از مردم به بازگردانی مواد وابسته است و این خود راهی برای گذران زندگی به شمار می رود.
دولت هیچ برنامه ای برای بازگردانی ندارد و زباله ها درون ظرف های بزرگ، در خارج شهر ریخته می شوند. هندی های بیكار در اطراف این ظرف ها پرسه می زنند و هر ماده قابل بازگردانی، را جست و جو میكنند. زباله های جمع آوری شده به كارخانه های كوچك كه البته در شرایط بد و با فناوری پایه كار میكنند، فروخته می شوند.
بسیاری از این كارخانه ها در محله های پرجمعیت بمبئی، پایتخت اقتصادی هند قرار گرفته اند. كارگران ساعت های طولانی با حقوق كم كار میكنند اما در كشوری كه نرخ بیكاری بالایی دارد، داشتن این شغل، هم غنیمت است.
مختار حامد برای بخش غیررسمی بازگردانی در هند كار میكند. او 15 سال دارد و مخارج زندگی خود را از بازگردانی ضایعات آلومینیم تأمین میكند. هر روز قبل از ساعت 7 صبح بیدار می شود و پس از صرف صبحانه كارش را شروع میكند. او یك ساعت را به ناهار اختصاص داده است و تا ساعت 8 بعدازظهر به كار ادامه میدهد. كار مختار ذوب قراضه های آلومینیم است. او در پایان روز در رختخوابی كه درست در كنار كوره است، می خوابد.
مختار تنها یكی از هزاران هندی است كه در یکی از بزرگترین شهرهای زاغه نشین در جنوب آسیا زندگی میكنند و از بازگردانی هر جسم آلومینیمی كسب درآمد میكنند. این افراد با این كار نه تنها از خود حمایت میكنند، بلكه خالق اقتصادی چند میلیون دلاری هستند كه اقتصاد منطق های را دچار دگرگونی كرده است و به مردم در امرار معاش یاری می رساند.
بازگردانی آلومینیم
در هند بازیافت آلومینیم شامل سه مرحله است. در آغاز، فراورده های آلومینیمی مصرفی و دورانداخته شده، به ویژه قوطی های نوشابه و نوشیدنی های دیگر جمع آوری می شوند. سپس قوطی ها در اسید، شناور می شوند تا برچسب ها و نام های تجاری از روی آن ها جدا شود. در پایان، قوطی ها خرد و در كوره، ذوب می شوند.
در كارخانه ای كه مختار كار میكند، قوطی ها به طور كامل ذوب میشوند. ماده مذاب به دست آمده در قالب ها ریخته میشود تا پس از سردشدن، به صورت میله های آلومینیمی، كه شمش نام دارند، درآیند. سپس میله ها به كارخانه دیگری انتقال می یابند و در آنجا دوباره ذوب میشوند. آنگاه فلز مایع در دستگاهی خاص به واحدهایی تبدیل میشود كه برای ساخت فراورده های آلومینیمی جدید مورد استفاده قرار میگیرند.
مختار مسئول كوره ای است كه در حفره ای به عمق 1m در زمین قرار دارد و قطر آن به نیم متر می رسد. دریچه ای كه در ته حفره قرار دارد، ارتباط آن را با یک لوله به سطح زمین برقرار میكند. از این راه اكسیژن به كوره میرسد. كوره با زغال سنگ روشن میشود و دمای بیش از 660°C ، یعنی نقطه ذوب آلومینیم را تولید میكند. مختار یک بوته ذوب پر از ضایعات آلومینیمی خرد شده را در بالای كوره قرار می دهد، جنس بوته ذوب، سیلیسیم كربید است كه تا دمای 2730°C ذوب نمی شود.
برتری های بازگردانی آلومینیم
بازیافت، مقدار زباله سوزانده یا دفن شده را كاهش می دهد. حسن ویژه این كار در مورد آلومینیم این است كه اگر قوطی های نوشابه قدیمی دفن شوند، باید قوطی های جدید را از آلومینیم نو كه از سنگ معدن آن به دست می آید، تهیه كرد. بنابراین بازیافت آلومینیم، افزون بر اثر سودمند زیست محیطی آن، از دیدگاه اقتصادی نیز به صرفه است اما باید یادآوری كرد كه بازیافت همه مواد از این دیدگاه، به صرفه نیست. برای نمونه، تولید پلاستیک از مواد اولیه، ارزان تر از بازیافت آن تمام می شود.
بنابراین زباله های پلاستیکی، اغلب سوزانده یا دفن میشوند، از جمله محدودیت های دیگر این است كه بازیافت شیشه های سبزرنگ هم مناسب نیست. نه به دلیل اینكه نمی توان شیشه را به طور نامحدود بازیافت كرد بلكه به دلیل ممكن نبودن تغییر رنگ این شیشه، چنین است؛ شیشه ای كه یکبار به رنگ سبز درآمد، برای همیشه به همان رنگ باقی می ماند. به همین دلیل است كه فراورده های فراوانی با شیشه سبز، وارد ایالات متحده می شوند اما تولید این نوع شیشه در آنجا محدود است؛ زیرا این شیشه، قابل بازیافت نیست. باید توجه كرد كه آلومینیم برخلاف فلزهایی همچون آهن زنگ نمیزند و به همین دلیل بازیافت آن آسان است.
تغییر زندگی
به لطف افرادی همچون مختار بخش بزرگی از آلومینیم در هند بازگردانی می شود. یک تفاوت بزرگ میان هند و ایالت متحده آن است كه در هند هیچ برنامه بازیافت دولتی وجود ندارد. هندی ها مجبور به جداسازی زباله هایشان نیستند؛ حال آنكه ساكنان ایالات متحده تشویق به انجام آن می شوند.
صدها هزار هندی سطل های زباله عمومی را برای مواد قابل بازیافت جست و جو میكنند. انجام دادن این كار، در محیطی آلوده سلامت آن ها را در معرض خطر قرار میدهد. كارگران كارخانه های بازیافت مانند مختار نیز با چنین خطرهایی روبه رو هستند. تجهیزات ایمنی برای آن ها فراهم نشده است؛ حتی اگر در نزدیکی یک كوره با دمای 660°C كار كنند. مختار 11 ساعت در روز كار میكند، زمان استراحت كمی دارد و هیچ شانسی برای رفتن به مدرسه ندارد. اگرچه او و دیگران در شرایط وحشتناكی كار میكنند اما هیچ جایگزینی برای گذراندن زندگی ندارند.
در ایالات متحده، بازیافت همانند یک عادت خوب به نظر می رسد كه برخی از ما سعی میكنیم آن را بپذیریم. در هند این كار راهی برای بقای زندگی است. در آنجا بازیافت آلومینیم به دگرگونی اقتصاد محلی كمك كرده است. این رویداد به ما یادآوری میكند كه بازیافت نه تنها محیط زیست را بهبود می بخشد بلكه می تواند كیفیت زندگی را تغییر دهد.
منبع:رشد

موشک های فضایی مانند موشکهای آتشبازی عمل می کنند . سوخت با ماده ای به نام اکسنده که حاوی گاز تسریع کننده احتراق یعنی اکسیژن است ، ترکیب می شود آنگاه این ترکیب که یک پیشران محسوب می شود می سوزد و گازهای داغی را تولید می کند این گازها منبسط می شوند و از طریق یک دماغه خارج می شود و سبب حرکت موشک به طرف بالا می شود.
این واکنش را برای اولین بار در قرن هفدهم ، دانشمند انگلیسی اسحاق نیوتن در قانون سوم حرکتش بیان کرد . او اظهار کرد که برای هر عملی ( خروج گازها ) عکس العملی است مساوی و بر خلاف جهت آن ( حرکت موشک ) .
اصول مشابه
اصول اساسی موشک های آتش بازی که در جشنها استفاده می شوند ، تفاوت چندانی با موشکهای پرتاب کننده فضاپیما ها ندارند . نیرویی که هر موشک را به طرف جلو حرکت می دهد ، نیروی پیشران نامیده می شود .
قدرت نیروی پیشران به سرعت خارج شدن گاز خروجی بستگی دارد . نیروی پیشران به موشک شتاب می دهد و سبب افزایش سرعت آن می شود . مقدار شتاب نیز بستگی به جرم موشک دارد هر چه موشک سنگین تر باشد ، برای رسیدن به فضا ، به نیروی پیشران بیشتری نیاز دارد .
تا زمانی که موتورهای موشک روشن و در حال تولید نیرو پیشران هستند ، شتاب فضاپیما نیز هر لحظه زیادتر می شود .
موتور موشک یا از سوخت مایع استفاده می کند یا جامد ، اما ممکن است یک موشک کامل در مراحل مختلف از هر دو نوع سوخت استفاده کند .
کارشناسان موشک هایی را پیشنهاد کرده اند که از انرژی اتمی به صورت سوخت استفاده می کنند ، زیرا آنها از نظر مصرف انرژی بسیار مقرون به صرفه اند . اما ترس از خطر استفاده از سوخت اتمی مانع استفاده از این نوع موشک ها شده است .
سوخت های پیشران از نوع سوخت و اکسنده نشکیل شده است . برای روشن کردن موشک ، کافی است یه جرقه به سوخت برسد آن را روشن کرده است سوخت تا قطره آخر می سوزد و از دماغه موشک خارج می شود .
اولین موشک را در قرن یازدهم در کشور چین ساختند . آنها موشکهایی بودند که از سوخت جامد استفاده می کردند .
سوخت این موشک ها نوعی باروت بود که از ترکیب نیترات پتاسیم ، زغال سنگ چوب و سولفور تشکیل شده بود .
سطح داخلی موشک که از سوخت جامد استفده می کند ، در وسط سوخت یک حفره ایجاد می شود که دور تا دور آن در حال سوختن است .
منبع ( شبکه پیام )
در بخش چهارم کتاب شیمی دو سوالی مطرح شده است به این صورت که از بین گازهای F2, O2 کدامیک آسانتر به مایع تبدیل می شود ؟
در مورد ترکیبهای کوالانسی مولکولی ناقطبی نقطه جوش به سه عامل بستگی دارد که عبارتند از
1- جرم مولکولی : با افزایش جرم مولکولی نقطه جوش افزایش می یابد.
2- حجم مولکولی : با بزرگتر شدن اندازه مولکولها نقطه جوش افزایش می یابد.
3- سطح تماس مولکولی : هر چه مولکولها سطح تماس بیشتری با هم داشته باشند نیروهای جاذبه بین آنها قویتر بوده و نقاط ذوب و جوش بالاتری دارند.
مولکولهای O2 , F2 هر دو مولکول دو اتمی هستند پس شکل آنها خطی بوده و عامل سطح تماس در این مورد اثری ندارد. بین این دو مولکول جرم F2 بیشتر از O2 می باشد، اما حجم مولکول اکسیژن نسبت به فلوئور بیشتر است. در این مورد عامل حجم تاثیر بیشتری دارد. یعنی نقطه جوش O2 نسبت به F2 بیشتر است.
مقایسه دمای جوش گازهای N2 , O2 و NO
در کتاب شیمی معدنی دکتر ملاردی و دکتر آقا بزرگ جلد دوم مطالبی به این صورت بیان شده است. در مورد مولکول نیتروژن N2 ، وجود پیوند سه گانه، کوچکی حجم مولکول و جاذبه زیاد بین هسته و الکترونها، مقدار نیروهای لاندون ناچیز، و در نتیجه نقطه جوش آن بسیار پایین است. جدول زیر ارتباط بین قطبیت، تعداد الکترونها و جرم مولکولی را با نقطه جوش نشان می دهد.
|
|
ممان دو قطبی |
تعداد الکترون |
جرم مولکولی |
نقطه جوش در شرایط استاندارد |
|
N2 |
0 |
14 |
28 |
196- |
|
O2 |
0 |
16 |
32 |
183- |
|
NO |
07/0 |
15 |
30 |
151- |
مشاهده می کنید با اینکه NO جرم کمتری دارد اما به دلیل ممان دوقطبی ضعیف خود نقطه جوش بالاتری دارد. در مورد N2 , O2 نیز تاثیر جرم و اندازه کوچک مولکول N2 موجب شده تا نقطه جوش پایینتری داشته باشد.
مقایسه دمای ذوب و جوش F2 , O2 , N2
در کتاب شیمی معدنی هیویی رابطه بین نقطه ذوب و ساختار بلوری این سه ترکیب به صورت زیر آورده شده است.
|
|
شعاع اتمی |
ساختار بلوری |
دمای ذوب |
دمای جوش |
|
F2 |
Pm 72 |
مکعب ساده |
233- |
188- |
|
O2 |
Pm 74 |
مکعب ساده |
4/218- |
9/182- |
|
N2 |
Pm 74 |
هگزاگونال |
210- |
8/195- |
دمای ذوب : N2 > O2 > F2
نیتروژن به دلیل ساختار بلوری هگزاگونال که نسبت به مکعب ساده فشرده تر است، شبکه بلور متراکم تری داشته و نقطه ذوب آن بالاتر است. بین اکسیژن و فلوئور، حجم مولکولی بیشتر نیتروژن نقطه ذوب آن را بالاتر برده است.
دمای جوش : O2 > F2 > N2
نیتروژن به دلایلی که در بالا آورده شد، کمترین نقطه جوش را دارد. بین اکسیژن و فلوئور، حجم مولکولی بیشتر موجب بیشتر بودن نقطه جوش اکسیژن می باشد
لازمه تشکیل پیوند کووالانسی بین دو اتم، این است که هر یک ازدو اتم، اربیتال تک الکترونی داشته باشند.

«یمیایی است. احتمالاً لباسی را که پوشیده ایم از
الیاف مصنوعی مانند نایلون، اُرلُن یا داکرون است. غذایی که می خوریم ممکن
است در پوشش پلاستیکی بسته بندی شده باشد که آن هم یک محصول صنعت شیمیایی
است. اگر بامروز
در مسیر خود حتماً وسایل نقلیه ی گوناگونی را دیده ایم. لاستیک چرخهای این
وسایل همگی محصول صنعت شرای کنترل عفونت در بدن آنتی بیوتیک خورده ایم در واقع از یک
ماده ی دارویی شیمیایی استفاده کرده ایم. پس، هر چیز در زندگی ما به شیمی
مربوط می شود»
«چون رشته شیمی تقریباً همه ی جوانب زندگی ما را در
بر می گیرد، شیمیدانان به طرحهای پژوهشی متنوعی می پردازند که تنوع آن ذهن
را به حیرت می اندازد. بسیاری از شیمیدانان دست اندرکار بیماری هایی مانند
ایدز هستند که در حال حاضر غیر قابل علاج اند.
شیمیدانان هم چنین شدیداً درگیریافتن راههایی برای بهبود کیفیت محیط
اند. ادامه ی اوزون در استراتوسفر نرساند، خواهد انجامید. پژوهش در باره ی
شیمی آب دریا به امکان می دهد تا راههای آبی بسیاری را که طی سالها سوء
استفاده و غلظت شدیداً آلوده شده اند، تمیز کنیم.
شیمیدانان با
همکاری نزدیک با کارکنان سازمان حفاظت محیط درصدد یافتن روشهایی برای تمیز
کردن زباله دانها و محلهای تخلیه زباله هستند که به طور نامناسب یا غیر
قانونی باقی مانده اند.»
«بعضی از مخاطره آمیزترین مواد، همچنین بعضی از موادی که محیط زیست
را بسیار آلوده می کنند، در خانه ی ما وجود دارند. مواد مخاطره آمیز شامل
مواد سمی، خورنده و آتشگیرند. حشره کشها، بعضی از داروها، ضد یخ و الکل
صنعتی چند نمونه از مواد سمی است. مواد خورنده، پارچه ها، فلزات و چیزهای
دیگر را تباه می کنند. مواد پاک کننده ی دستشوییها و اجاقها، مواد رنگبر و
اسید باتری اتومبیل از مواد خورنده هستند. مواد آتشگیر موادی هستندکه به
آسانی می سوزند مانند بنزین، گاز فندک و بعضی از افشانه ها.
این
گونه مواد برای سلامتی و ایمنی انسان و جانوران دست آموز خانگی مخاطره
آمیزند، تنها یک لیتر نفت که روی زمین ریخته شود، ممکن است مخزن آب را
آلوده کند. مواد پیشران قوطی افشانه ها که در جو آزاد می شوند، لایه ی اوزن
را تخریب می کنند.
ما می توانیم به جای بعضی از این مواد، از مواد
بی خطر استفاده کنیم. مثلاً به جای فراورده های پاک کننده ی در و پنجره که
شامل فسفاتها و آمونیاک هستند، محلولی از آب و سرکه به کار ببریم. سرکه فقط
محلول ملایمی از استیک اسید است و شیمی نیست. هم چنین می توان برای پاشیدن
محلول ها یا مواد دیگر به جای قوطیهای افشانه ای از پمپ استفاده کرد.»
پوششهای که مانع خوردگی می شوند
»خوردگی
واژه ی شایعی است که برای توصیف واکنش بعضی از فلزات با محیط انها بکار
برده می شود. برای مثال، آهن یک فلز فعال است و به کمک پاره ای از خواص
ویژه ی آب، با اکسیژن هوا ترکیب شده، آهن (III) اکسید یا زنگ آهن می دهد.
یک
راه ممکن برای جلوگیری از زنگ زدن آهن این است که آهن یا فولاد را با فلزی
که با محیط خود واکنش نمی دهد بپوشانیم. زینت دادن بعضی قسمتهای اتومبیل
با آب کروم، مثالی از این نوع پوشش است. پوشش با فلز روی نیز روش دیگری
برای محافظت فلز است. در شرایط معمولی، فلز روی با آب و کربن دی اکسید در
هوا واکنش داده، پوشش روی کربنات تشکیل می شود که در برابر خوردگی بیشتر
مقاومت می کند. برای مثال، نمی توان میخ را برای جلوگیری از زنگ زدن
گالوانیزه (با روی پوشاندن) کرد.
بعضی شکلهای خوردگی مانند ترکیبات
روی کربنات، مفید است. برای مثال، آلومینیوم وقتی در معرض هوا قرار می
گیرد. پوشی از آلومینوم، اکسسید روی آن تشکیل می شود که از خوردگی بیشتر
جلوگیری می کند. زنگار روی مجسمه ها و تندیسهاو پوشش سبز روی بسیاری از
اشیای برنزی یا برنجی Cu2CO3(OH)2 است که آن نیز یک پوشش محافظ است.»
مه دود
«مه
دود در اصل به صورت مخلوطی از دود و مه تعریف می شود. اما امروزه واژه ی
مه دود به طور اختصاصی تر برای مه دود فوتوشیمیایی به کار می رود. این نوع
مه دود با شکسته شدن مولکولهای مواد آلوده کننده موجود در هوا بر اثر نور
خورشید ایجاد می شود. بسیاری از خواص مه دود فوتوشیمیایی ناشی از واکنشهای
اکسیژن، اکسیدهای نیتروژن و هیدروکربن های موجود در جّو است. (هیدروکربن ها
موادی شامل کربن و هیدروژن مانند بخار بنزین است.)
اتومبیل ها عامل
اصلی مواد خامی هستندکه مه دود تولید می کنند. اکسیدهای نیتروژن، به ویژه
نیتروژن دی اکسید و دودهای هیدروکربن ها با هوا و آلوده کننده های دیگر
آمیخته می شوند. این مخلوط بر اثر نور خورشید، اوزون، دیگر اکسیدهای
نیتروژن و اکسیدهای گوگرد تولید می کند.
وقتی این محصولات در شهری
که با تپه ها و کوهها احاطه شده است به دام می افتند، مه دود شدت خاصی پیدا
می کند. این شدت غالباً با وراون شدن یک لایه ی دمایی جو، افزایش می یابد.
وارونگی نتیجه یک لایه ی هوای سرد است که روی ناحیه ای گرم قرار می گیرد و
مانع صعود هوای گرم و پراکندگی گازها می شود.
چون نور آبی با ذرات مه دود بیشتر پراکنده می شود این رنگ با نیتروژن دیاکسید قهوه ای رنگ موجود در هوا تشدید می شود. مه دود علاوه بر آنکه هوا را ناسالم و غیر بهداشتی می کند، سبب سوزش و خارش چشم و ریزش اشک می شود که احتمالاً علت آن مواد ترکیب آلی مانند فرمالدهید، آکرولئین، پروکسی استیل نیترات (PAN) است. گیاهان و در نتیجه کشاورزی و جنگل ها نیز بر اثر مه دود آسیب می بینند.
طی سالها برای کنترل دود اگزوز اتومبیل ها که منابع
عمده ی مه دودند کوششهایی به عمل آمده است، از آن جمله اند: اصلاح موتورها،
مبدلهای کاتالیزوری و مشعلهای پس سوز که سوختن گازهای زائد را کامل می
کنند. حتی اگر واکنشهای فوتوشیمایی هم نباشد، اگزوز اتومبیل ها گاز کربن
مونوکسید و بعضی از ذرات را تولید می کنند.
از این گذشته، همه انواع
سوختن از جمله سیگار کشیدن نیز در ایجاد مه دود دخالت دارند. مراکز صنعتی
مانند پالایشگاهها و مراکز سرویس اتومبیل ها، بخارهای هیدروکربن خارج می
کنند. حتی پختن غذا با زغال چوب مقداری هیدروکربن و ذرات آلوده کننده در
هوا وارد می کند.
بدیهی است که حذف همه مواد آلوده کننده ممکن نیست، اما وضع قانون و رعایت مقررات در کاهش میزان مه دود تاثیر زیادی داشته است.»
«از روزگاران قدیم نان یکی از مظاهر اساسی تمدن بوده است. نان خوب
حاصل واکنشهای شیمیایی است. اجزای اصلی نان مخمر، آرد، آب و نمک است. هر یک
از این اجزا در پختن نان نقش دارد.
آرد شامل نشاسته و پروتئین است.
آرد و آب با مخمر آمیخته می شود تا خمیر به دست آید در خمیر آمیخته، آب و
پروتئین زنجیره های مولکول در هم پیچیده ای به نام گلوتن ایجاد می کند.
وقتی خمیر ورز داده می شود این زنجیرها ردیف می شوند و خمیر صاف و یکدست می
شود. نشاسته ی موجود در خمیر هم با آب به صورت ماده ای ژله شکل در می آید و
ساختار خاصی به خمیر می دهد.
مخمر، موجودی زنده و تک سلولی از نوع
قارچ یا کپک است. وقتی مخمر با آب فعال می شود نشاسته موجود در آرد را هضم
می کند و با این عمل کربن دی اکسید و الکل آزاد می شود.
در پختن نان، کربن دی اکسید به صورت حباب در می آید و گلوتن موجود
در خمیر این حبابها را محبوس می کند. وقتی که مخمر، کربن دی اکسید تولید می
کند، خمیر «پف می کند» یا به اصطلاح در می آید. نمک، طعم نان را بهتر می
کند و از فرو پاشی گلوتن و ورآمدن بسیار سریع نان جلوگیری می کند.
به
هنگام پخته شدن نان، گاز محبوس در حبابها منبسط و سلب پشترور آمدن خمیر می
شود در این حال مخمر کشته و الکل تبخیر می شود که رنگ و بوی فریبنده ای به
نان می دهد.»
فشار هوا به لاستیک اتومبیل شکل می دهد.
«لاستیک
های اتومبیل از نظر ایمن بودن باید از استانداردهای بالایی برخوردار
باشند. این لاستیک باید با سطح جاده اصطکاک کافی ایجاد کنند تا از سرخوردن
لاستیک جلوگیری شود.
لاستیک ها باید طوری عمل کنند که با عبور
اتومبیل از روی سطوح ناهموار سرنشینان اتومبیل ناهمواری سطح جاده را کمتر
احساس کنند. لاستیک های اتومبیل همچنین باید به هنگام پیچیدن و دور زدن
اتومبیل طوری عکس العمل نشان دهند که تغییر شکل آنها باعث نشود که نتوانند
کار خود را انجام دهند. لاستیک اتومبیل ها این وظایف را که گاهی مغایر نیز
هستند به دو طریق انجام می دهند. یک طریق ساخت الیافی است که روی آن با
لاستیک پوشانده می شود. طریقه ی دیگر باد کردن لاستیک اتومبیل با هواست.
مولکولهای هوا به وسیله پمپ هوا به درون لاستیک رانده می شود. غلظت
مولکولهای هوا در داخل لاستیک بیشتر از خارج آن است. بنابراین فشار وارد
شده به وسیله ی این مولکولها بیشتر از فشار جو است. ساخت لاستیک اتومبیل به
گونه ای است که فشار بیشتر داخل لاستیک نسبت به فشار جو، لاستیک را روی
لبه ی رینگ می فشارد. ساخت لاستیک مانع از انبساط آن می شود. فشار وارد شده
به وسیله ی مولکولهای هوا باعث می شود که لاستیک شکل خود را به خصوص در
پیچها حفظ کند. برای مثال، وقتی لاستیک اتومبیل به یک دست انداز برخورد می
کند حجم، ناگهان کاهش می یابد. کاهش حجم باعث افزایش فشار هوای داخل لاستیک
می شود. مولکولهای هوا به نوبه خود روی دیواره های داخلی لاستیک فشار وارد
می کنند و لاستیک فوراً به شکل و حجم اولیه ی خود بر می گردد.»
«بیشتر وسایل الکترونیکی و حتی بعضی از لوازم الکتریکی خانگی را همراه با بسته کوچکی از بلورهای بی رنگ بسته بندی می کنند. این بلورها، ژل سیلیس است که ماده ای بی آب می باشد. بعضی از مواد بی آب مانند ژل سیلیس، به آسانی آب جذب می کنند و می توان آنها را برای گرفتن آب از مواد دیگر به کار برد. وقتی از ماده بدون آب به این منظور استفاده می شود ان را خشک کننده می نامند. مقصود از قرار دادن یک بسته خشک کننده در بسته بندی یک وسیله الکترونیک این است که بخار آب را از هوا جذب می کند و وجود آن باعث می شود که قسمتهای فلزی این وسیله ی الکترونیکی به وسیله رطوبت هوا خورده نشود. هم چنین با این کار از متراکم شدن بخار آب در سیم پیچهای این وسیله جلوگیری می شود. چون حتی قطره کوچکی آب روی مدار الکتریکی می تواند با ایجاد جریان کوتاه مانع کار آن شود. ژل سیلیسی را به وسیله رسوب دادن از ملحول سدیم سیلیکات تهیه می کنند. این رسوب توده ای ژله مانند است که آن را می شویند تا با ناخالصیهایش جدا شود.

محصول به دست آمده شکلی از سیلیس آبپوشیده به فرمول H2SiO3 است این ماده ی آبپوشیده را سپس گرم می کنند تا آب آن خارج شود. سیلیس حاصل می تواند معادل 40% وزن خود آب جذب کند.»
«اگر مربا یا ژله را دوست دارید، می توانید از یک مولکول دراز موسوم به پکتین سپاسگزار باشید.
پکتین
به طور طبیعی در انگور، توت فرنگی، سیب سبز و میوه های ترشی وجود دارد.
پکتین مولکول دراز و زنجیر مانندی است که از ساختارهای کوچکتری شبیه به
ساختار قندها ساخته شده است. پکتین موجب ژل شدن کنسرو می شود.

برای تهیه کنسرو از میوه هایی که دارای پکتین طبیعی اند، ابتدا میوه ها
را می جوشانند تا پکتین از دیواره های سلولی آزاد شود. به میوه هایی که به
طور طبیعی پکتین ندارند، پکتین می افزایند. در آب میوه ی در حال جوش،
مولکول های پکتین موجب می شود که مولکول های آب آنها را احاطه کنند. میوه
هایی مانند انگور و سیب سبز اسیدی اند و بار موجود بر روی مولکولهای پکتین
را خنثی می کنند. خنثی شدن میوه هایی که به طور طبیعی اسیدی نیستند، با
افزودن آب لیمو انجام می شود. شکر میافزایند و محلول را می جوشانند تا غلظت
شکر به 60 تا 65% برسد. محلول غلیظ شکر مولکول های آب را از پکتین می
گیرد. در این حالت، مولکول های پکتین به یکدیگر می پیوندند و اجزای دیگر را
به دام می اندازند تا ژلی مانند ژلاتین تشکیل شود.
مقدار پکتین
اضافه شده به کنسروها اهمیت دارد. پکتین خیلی زیاد موجب لاستیکی شدن کنسرو
می شود، پکتین خیلی کم موجب روان ماندن آنها می شود. به همین ترتیب اگر
میوه اسید کافی نداشته باشد، یا شکر افزوده شده کم باشد، ژل تشکیل نمی شود و
شربت درست می شود.
تهیه کنسرو در بسیاری از خانواده ها باعث می شود
که در سراسر سال از میوه ها استفاده کنند. حفظ موازنه دقیق در افزودنیها
یک هنر به شمار می آید. البته تهیه کنندگان کنسرو شیمی این فرایند را نمی
فهمیده اند ولی حاصل کار لذت بخش بوده است.»
«تقریباً هر فردی حل شدن ژلاتین را در آب و بسته شدن آن را در یخچال
مشاهده کرده است. این رویداد به علت ساختار خواص پروتئیهایی است که ژلاتین
را به وجود آورده اند.
ژلاتین، کولاژنی است که تغییر ساختار پیدا
کرده است. کولاژن، پروتئینی است که در بافت پیوندی حیوانات وجود دارد مرکب
از سه رشته جداگانه از آمینو اسیدهاست که به هم پیچیده شده اند. وقتی آن را
در آب گرم کنیم، پیوندهای ضعیفی که کولاژن را به وجود آورده اند شکسته شده
رشته های پروتئیها از هم باز می شوند.
ژلاتین به طور کلی در آب داغ حل می شود. ژلاتین حل شده را سپس به مایعات
دیگر می افزایند. ژلاتین به طور کلی در آب داغ حل می شود. پیوندهای ضعیف
از نو تشکیل می شوند، اما به طور کاتوره ای شبکه ی بزرگی را به وجود می
آورند که آن مایع در خود نگه می دارد. نیم جامدی که تشکیل می شود، ژل می
نامند. این ژل را هر اندازه بیشتر سرد کنیم سخت تر می شود زیرا پیوندهای
ضعیف بیشتری فرصت تشکیل شدن پیدا می کنند.
گاهی ژل تشکیل نمی شود یا
اینکه به اندازه کافی سفت نیست. بهترین شرایط برای تشکیل این ژل خاص PH
حدود 5 و افزودن مقدار کمی شکر است. بنابراین وقتی میوه اضافه می کنیم
آنهایی که اندکی اسیدی هستند شانس بهتری برای تشکیل ژل دارند.»
استفاده
از آناناس در ژل، ناپایداری ژل را نشان می دهد. آنزیمی که در آناناس تازه
وجود دارد، رشته های پروتئین را به تکه های کوچکی می شکنند که تشکیل ژل نمی
دهند. اما آناناس پخته شده یا کنسرو شدن این اثر را ندارد زیرا آنزیمی که
موجب تخریب ژلاتین می شود خود در جریان پخته شدن از بین رفته است.
شیمیدانان برای ساختن هیدروژن از گیاهان راهی جدید یافته اند، راهی
که به تهیه هیدروژن با مقدار زیاد و ارزان می انجامد و مقدار آن به حدی
خواهد بود که بتوان از آن به عنوان سوختی سبز (تمیز) استفاده کرد.
گروهی
از محققان محلول گلوکز را که از بافتهای گیاهی بدست آمده بود تا دمای 200
درجه سلسیوس و تحت فشار حرارت دادند، کاتالیزگر مورد استفاده در این آزمایش
خرده های پولونیوم (Po) پخش شده درون لایه ای اسمزی از آلومینیوم اکسید
بود. این فرآیند گلوکز را به هیدروژن، کربن دی اکسید و مقدار کمی متان
تبدیل می کند. در این آزمایش چنانچه به جای گلوکز از متانول استفاده شود
نتایج به مراتب بهتر خواهد بود. متانول (به عنوان سوختهای زیستی) از منابع
گیاهی مانند ذرت و گندم بدست می آیند. اما باز هم هدروژن نسبت به این
سوختها به مراتب بهتر و سالمتر است.

راههای دیگری نیز برای بدست آمردن هیدروژن وجود دارد، به طور مثال:
استفاده از الکتریسیته برای تجزیة مولکولهای آب، همچنین می توان هیدروژن را
از گلوکز و تحت بخار فشرده استخراج کرد، اما هزینة آن بسیار بالاست. راه
دیگر تجزیة باکتریائی پسماندهای زیستی به هیدروژن است( مانند تخمیر نشاسته )
اما مشکل آنست که در کارخانجات و صنایع این کار عملی نیست.
گروه
محققان امیدوارند که با تولید سوخت ارزان زندگی انسانها را از وابستگی به
سوختهای فسیلی نجات دهند. زمانی که هیدروژن در هوا می سوزد، مقدار زیادی
انرژی آزاد می کند و تنها محصول جانبی این فرآیند شیمیائی آب است.
انرژی2H2(g) + O2(g) ® 2H2O(g) +
در حالیکه سوختهای فسیلی مقدار زیادی گازهای گلخانه ای تولید می کنند.
بنا بر نظر پژوهشگران، موتورهای درونسوز به زباله دان تاریخ خواهند پیوست! و قرن آینده متعلق به خودروهائی است که نه با بنزین بلکه با سلولهای سوختی هیدروژنی حاصل از تجزیة مولکولهای آب به حرکت در خواهند آمد. در حالی که موتورهای درونسوز بسیار تمیزتر از یک نسل پیش از خود هستند. با این همه این موتورها باید با قوانین سخت تر انتشار کمتر دود، گوگرد و گازهای گلخانه ای منطبق شوند. به نظر پژوهشگران اگر ما خواستار کاهش شدید
منبع : شیمی و زندگی
واکنش تجزیه هیدروژن پراکسید، گرماده است.
سوسک هنگام احساس خطر، یکی دو قطره هیدروژن پراکسید و کمی آنزیم را هم زمان از دو کیسه ی جداگانه به سمت جانور شکارچی پرتاب می کند. این دو مایع در سر راه خودبا هم مخلوط و هم زمان از یک لوله خارج می شوند.
آنزیم سبب تجزیه هیدروژن پراکسید شده، گرمای زیادی تولید می کند.این گرما سبب داغ شدن مایع شده و برخورد آن به شکارچی سبب فرار آن می شود.
در برخی موارد ، فرمول ساختاری پیشنهاد شده برای یک مولکول ، نشان دهنده خواص واقعی و کامل مولکول نیست . در اینصورت برای نشان دادن خواص کامل هر مولکول بجای یک فرمول واحد ، از چندین فرمول ساختاری که مجموعا خواص مولکول مورد نظر را نشان می دهند ، استفاده می شود . این فرمولهای ساختاری را که تنها از نظر آرایش الکترونها با هم تفاوت دارند ، شکلهای رزونانسی ماده می گویند . ساختار واقعی مولکول ، میانگینی از ساختارهای رزونانسی است که به آن هیبرید رزونانسی می گویند .
این حالت زمانی رخ می دهد که یک پیوند دوگانه در مجاورت پیوندهای یگانه کاملا مشابه قرار گیرد . به عنوان مثال مولکول SO2 دارای یک پیوند دوگانه (S=O) و یک پیوند یگانه (S-O) است . بنابراین بایستی انرژی پیوند S=O بیشتر از S-O و طول پیوند S=O کمتر از S-O باشد . اندازه گیری طول پیوند و انرژی پیوندها در مولکول SO2 نشان می دهد که هر دو پیوند گوگرد – اکسیژن از نظر انرژی و طول پیوند با هم برابر بوده و حدواسطی (میانگینی) بین پیوند یگانه و دوگانه است . در واقع پیوند گوگرد – اکسیژن ، بین یگانه و دوگانه یعنی ۱٫۵ گانه است . این ساختار مولکول SO2 را هیبرید رزونانس می گویند .
در مولکولها و یونهای زیادی می توان هیبرید رزونانس را مشاهده کرد . مانند :مولکولهای O3 , SO2 , SO3 , C6H6 و یونهای کربنات ، سولفیت ، سولفات ، فسفات ، کربوکسیلات
#- طول پیوند دوگانه از یگانه کمتر و انرژی پیوند آن از یگانه بیشتر است . مثلا طول پیوند C=C از طول پیوند C-C کمتر و انرژی پیوند C=C از انرژی پیوند C-C بیشتر است.
#- رزونانس یون کربوکسیلات را درشیمی4 فصل ۳ می خوانید .
|
|
||
|
کاربرد دارویی مواد شیمیایی
آب اکسیژنه (هیدروژن پراکسید): این ماده جهت تمیز کردن زخمها، ضدعفونی سطوح، جدا کردن پانسمان چسبیده به زخم، دهان شویه و خوشبو کننده ی دهان، جهت خارج کردن ترشحات گوش و شستشوی گوش خارجی كاربرد دارد.
آلومینیم استات: جهت درمان امراض قارچی پوست (کچلی و کاندیدیاز) و همچنین گزش حشرات و نباتات به كار مي رود.
بنزوييك اسید (جوهر حسن لبه): به عنوان نگهدارنده در مواد غذایی و نوشیدنی ها ونیز جلوگیری از رشد میکروب ها و رفع امراض قارچی پوست (کچلی و کاندیدیاز).
تارتاریک اسید (جوهر درد): جهت جوشان کردن قرص ها و گرانول ها به کار می رود.
روی اکسید (توتیا): جهت درمان تب خال دهانی، در کرم های ضد آفتاب، جهت درمان هموروئید داخلی و خارجی، ضدعفونی، سوختگی، ضد خارش بوده و جهت رفع گزش حشرات و نباتات و نیز ضد نور و کک و مک و زیادی رنگدانه به کار می رود.
سدیم هیدروژن کربنات (جوش شیرین): جهت درمان اسهال، ضد سنگ های اوراتی و سیستئینی، جهت درمان زخم معده و دوازدهه، جهت کاهش اسید معده و ضد استفراغ بوده و جهت احیای قلبی – ریوی، شوک و پیشگیری، درمان ترمبوزعروقی، عمقی و آمبولی به کار می رود. همچنین در کم خونی همولیتیک، درمان نقرس و زیادی اوریک اسید خون، رفع مسمومیت با بار بیتوریک ها و سالیسیلات ها، رفع مسمومیت با الکل چوب (متانول) و اسیدهای ضعیف به کار می رود.
پتاسیم پرمنگنات: جهت درمان اگزما، امراض قارچی و میکروبی پوست (کچلی و کاندیدیاز)، شستشوی زخم ها و ضدعفونی سطوح، غرغره عفونت های قارچی و میکروبی پوست، شستشوی مثانه و سوند مثانه، دهان شویه و خوشبو کننده دهان (محلول 1 در4000) جهت رفع مسمومیت با آلکالوئید ها و همچنین تحریک استفراغ (در سموم خورده شده) و ضد خونریزی سطحی به کار می رود.
باریم سولفات: در تشخیص پزشکی به کمک اشعه ایکس، جهت رادیو گرافی معده و روده های باریک و کلون به کار می رود.
سدیم تیوسولفات: جهت رفع امراض قارچی پوست، رفع مسمومیت با سیانیدها (بعد از تزریق وریدی سدیم نیتریت) و رفع مسمومیت با آرسنیک به کار می رود.
دی نیتروکلروبنزن: جهت درمان طاسی منطقه ای (محرک رشد مو است) و نیز جهت رفع زگیل، پینه و میخچه كاربرد دارد.
روی سولفات: جهت درمان شوره ی سر و کک و مک و حفظ رنگ موهای بور و خرمایی، جهت درمان زوال عقل سالمندان و نیز درمان آکنه و لگاریس التیام زخم به کار می رود.
فرمالدئید: جهت رفع زگیل، پینه و میخچه، کشتن اسکولکس ها در کیست هیداتیک، جهت ضدعفونی لوازم و اطاق عمل، رفع تعریق زیاد و زگیل کف پا و نگهداری بافت بیوپسی به کار می رود.
فنل: این ماده بی حس کننده، ضد عفونی کننده و عصب کش دندان بوده و جهت دندان شویه و خوش بو کردن دهان به کار می رود.
نقره نیترات: جهت درمان زگیل، پینه و میخچه، ضدعفونی سوختگی، جلوگیری از خون ریزی بینی و نیز ضد خونریزی سطحی است.
آلومینیم هیدروکسید: جهت درمان اسهال مرمن، رفع زیادی اسید معده، ضد سنگهای فسفاته ادراری، درمان زخم معده و دوازدهه، ضد استفراغ و ... به کار می رود.
توجه داشته باشید که برخی از این مواد (مخصوصا در غلظت بالا) میتواند کشنده باشد. و برای مصارف درمانی هرکدام از این مواد غلظت، مقدار مصرف و نوع مصرف خاص خود را دارد. | ||
تترائیات : از اقای نصرالهی
حتماً با رباعیات خیام آشنا هستید . اشعاری که در دو بیت بر وزن « لا حَولَ و لا قُوَّةَ اِلاّ بِالله » سروده شده اند .
اینجانب در ادامه شعرسرایی خود ! بر آن شدم تا اشعاری بسرایم و نام آن ها را « تترائیات » بر وزن «رباعیات» بگذارم . امیدوارم که مورد پسند شیمیدانان شعردوست ! قرار گیرد .
اوزون
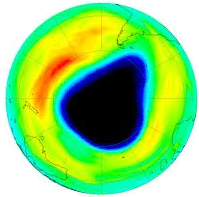
ما را برهان از خطر فوق بنفش ترمیم کن آن حفره و آن چاک، اوزون
مدل اتمی بور
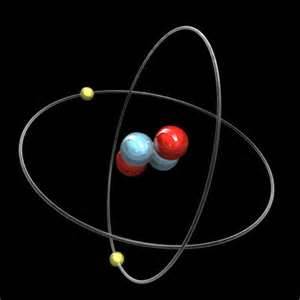
این دایره ها حلقهی کیهانی نیست وین گویچه ها ملعب چوگانی نیست
این حرکت دوّار به دور مرکز پایاست و یک لحظه و دم فانی نیست
پرتوزایی
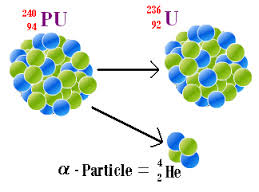
روزی اتمی هستهی خود را بشکست یک پرتوی آلفا ز برش بیرون جست
زین روی دگر عنصر دیروز نبود چون چار عدد ز جرم خود داد ز دست
جزوه شیمی آلی دبیرستان
کاری از مهندس سجاد شیری

نام فایل : جزوه شیمی آلی دبیرستان
حجم : 848 کیلوبایت
دانلود : لینک مستقیم
رمز فایل : www.konkur.in
منبع : سایت کنکور
دانلود جزوه شیمی 2 , فصل 5
کاری از استاد فرشاد میرزایی
شامل موضوعات : ویژگی کربن – دگر شکل و آلوتروپ کربن -الماس و گرافیت-هیدروکربن های سیرشده-نام گذاری آلکان ها و آلکیل ها – آلکان های شاخه دار-آلکن و آلکیل – واکنش پذیری-ایزومر ساختاری-گروه عاملی-هیدرو کربن های حلقوی-تولوئن-نفتالن-آسپرین-فنول-انرژی پیوند
در ضمن اگر شما کنکوریهای عزیرسوالی در مورد درس شیمی یا کنکور شیمی دارید می تونید از طریق ایمیل زیر با جناب مهندس میرزایی در میان بگذارید farshadmirzayi@ymail.com

پاسخ به سوالات درس شیمی شما در تاپیک شیمی انجمن کنکور
http://forum.konkur.in/forum10.html
دانلود جزوه شیمی 2 , فصل 5
حجم : 901 کیلوبایت
دانلود : لینک مستقیم | پرشین گیگ
رمز فایل : www.konkur.in
منبع : وبسایت کنکور
دانلود جزوه شیمی 2 , فصل چهارم به صورت کامل
جزوه ای کامل و عالی از مهندس فرشاد میرزایی
شامل موضوعات : مولکول های قطبی و نا قطبی- فرمول مولکولی - فرمول تجربی – فرمول ساختاری – نیروی بین مولکولی – پیوند کووالانسی – تفاوت جامد مولکولی با ترکیب یونی – انرژی پیوند کووالانسی قطبی و ناقطبی – قوانین عدد اکسایش – نام گذاری ترکیبت مولکولی - مولکول های متقارن – ناقطبی و متقارن
اختصاصی سایت کنکور

پاسخ به سوالات درس شیمی شما در تاپیک شیمی انجمن کنکور
http://forum.konkur.in/forum10.html
دانلود جزوه شیمی 2 , فصل چهارم کامل
حجم : 6.85 مگابایت
دانلود : لینک مستقیم | پرشین گیگ
رمز فایل : www.konkur.in
منبع : سایت کنکور
جزوه شیمی سوم دبیرستان مطابق با کتاب جدید
کاری از مهندس فرشاد میرزایی

نام فایل : جزوه شیمی (3) مطابق با کتاب جدید
حجم : 3.38 مگابایت
دانلود : لینک مستقیم
رمز فایل : www.konkur.in
منبع : سایت کنکور
|
|